ویروس پاپیلومای انسانی (HPV) و ارتباط آن با سرطان دهانه رحم

بيش از 120 نوع ويروس HPV شناخته شده است كه بيش از 40 نوع آن ميتواند منجر به ايجاد عفونتهاي تناسلي در مردان و زنان شود. از اواسط سال 1970 بود كه ويروس پاپيلوماي انساني (HPV) به عنوان اتيولوژي اصلي سرطان دهانه رحم پيشنهاد گرديد.
ویروس پاپیلومای انسانی که به آن HPV گفته میشود، شایع ترین عفونت مقاربتی (STI) است. متاسفانه اکثر بیماران آلوده به عفونت HPV، اطلاعی از بیماری خود ندارند.
اگرچه مکانیسم های دقیق انتقال ویروس از فردی به فرد دیگر هنوز شناخته نشده است اما معمولاً از راه تماس جنسی به خصوص تماس تناسلی یا مقعدی منتقل می گردد. البته احتمال انتقال ویروس از راه ارتباط دهانی تناسلی نیز امکان پذیر است. در افراد هموسکسوال نیز امکان انتقال وجود دارد. افراد مبتلا می توانند سال ها بدون علامت باشند و در این مدت، ویروس را به شریک جنسی خود منتقل کنند. امکان دارد یک فرد بیش از یک ویروس HPV مبتلا شود. به صورت خیلی نادر امکان انتقال ویروس از مادر باردار مبتلا به نوزاد خود حین زایمان واژینال وجود دارد. در این مورد کودک می تواند مبتلا به پاپیلوس تنفسی (PRP) گردد که د واقع زگیل داخل گلو رشد می کند.
علایم بالینی مبتلا به HPV:
اکثریت مبتلایان بی علامت هستند و در صورت سالم بودن سیستم ایمنی، %90 موارد HPV از بدن مبتلایان پاک خواهد شد. تعدادی از انواع HPV تناسلی عامل ایجاد زگیل تناسلی میشوند و تعدادی دیگر میتوانند سلولهای طبیعی را غیر طبیعی نموده و سبب سرطان شوند. انواع HPV که باعث زگیل تناسلی میشود با انواعی که سبب سرطان میشود متفاوت است.
الف. زگیل تناسلی به صورت تودههای کوچک مجزا یا به هم متصل در نواحی تناسلی ایجاد میشود. زگیل میتواند کوچک و بزرگ، برجسته، مسطح یا شبیه گل کلم باشد. تشخیص زگیل بالینی بوده و با مشاهده میتوان آن را تشخیص داد .معمولاً طی چند هفته تا چند ماه پس از تماس جنسی فرد با فرد مبتلا در بدن فرد رشد میکند. در صورت عدم درمان زگیل سه حالت رخ میدهد، یا خود به خود حذف میشود یا بدون تغییر میماند و یا در اندازه یا تعداد افزایش مییابد. ولی باید توجه کرد، زگیل تبدیل به سرطان نمیشود.
ب. سرطان سرویکس %7/99 با HPV همراهی دارد و معمولاً تا مراحل پیشرفته بدون علامت است و همچنین متأسفانه در مراحل پیشرفته بسیار سخت درمان میشود. لذا مهمترین مسئله در کنترل سرطان سرویکس، غربالگری منظم کلیه خانمهای واجد شرایط میباشد. سرطان سرویکس دومین سرطان شایع در میان زنان جهان است.
سایر سرطانها که با درصد کمتری با ویروس HPV در ارتباط هستند عبارتند از سرطان مقعد، سرطان واژن و سرطان اوروفارنکس.
* درمان: اگر زگیل در ناحیه تناسلی پیدا شود، میتوان اصلاً درمان نکرد ولی روشهای درمانی متعددی دارویی و جراحی وجود دارد که در حال حاضر هیچکدام به دیگری ارجحیت ندارد.
در رابطه با سرطان دهانه رحم، اگر در غربالگری روتین، پاپ اسمیر غیر طبیعی وجود داشته باشد معمولاً در طول زمان خود به خود برطرف میشود. لذا بر اساس راهنمایی بالینی موجود با پاپ اسمیر غیر طبیعی برخورد میشود.
پروتکل انجام HPV به عنوان تست غربالگری سرطان سرویکس
انجمن سرطان زنان The Society of Gynecologic Oncology (SGO) انجمن آمریکایی برای کولپوسکوپی پاتولوژی دهانه ی رحم American Society for Colposcopy and Cervical Pathology (ASCCP) با همکاری پنج سازمان پزشکی ملی آمریکا (CAP, ASC, ASCP, ACS, ACOG) ، یک دستورالعمل موقت را برای تست HPV به عنوان آزمایش اولیه برای غربالگری سرطان دهانه رحم، منتشر کردند.
این دستورالعمل پیشنهاد میکند:
- آزمایش HPV به عنوان غربالگری اولیه می تواند برای زنان از سن 25 سالگی مورد توجه قرار گیرد. زنان با نتیجه منفی آزمایش HPV نیازی نیست که دوباره برای حداقل سه سال آزمایش شوند. این فاصله ی زمانی غربالگری در دستورالعمل های جدید برای یک نتیجه نرمال سیتولوژی نیز پیشنهاد می گردد. یک تست مثبت HPV
- نتیجه مثبت تست برای 12 ژنوتایپ دیگر HPV بجز 16 یا 18 باید با آزمایش سیتولوژی پیگیری گردد. به نظر می رسد استفاده از ترکیب تعیین ژنوتایپ و واکنش سیتولوژی برای زنان مثبت از نظر 12 ژنوتایپ دیگر hrHPV یک روش قابل قبول برای مدیریت زنان hrHPV مثبت است.

سیتولوژی آلودگی به HPV
بر طبق سیستم بتسدا موارد غیر طبیعی سلولهای سنگفرشی به 4 دسته تقسیم میشوند:
- ASC, Atypical Squamous Cells (ASC-US, ASC-H) LSIL, Low grade Squamous Intraepithelial Lesion HSIL, High Grade Squamous Intraepithelial Lesion Squamous Cell Carcinoma
نقش سیتولوژی سرویکس:
ازنتایج سیتولوژی به عنوان تشخیص قطعی و یا شروع درمان نمیتوان استفاده نمود،زیرا سیتولوژی سرویکس به عنوان یک تست غربالگر برای یافتن سلولهای غیرطبیعی سرویکس میباشد که ریسک تبدیل شدن به کانسر را دارا میباشند. پس با توجه به نتیجه سیتولوژی بیمارانی که نیاز به پیگیری بعدی مانند کولپوسکوپی و یا بیوپسی دارند انتخاب می شوند.
البته سیتولوژی، بخصوص پاپ اسمیر معمولی محدودیتهایی را دارا میباشد:
- موارد unsatisfactory در %8 موارد دیده میشود. موارد مثبت کاذب در 20-%30 موارد گزارش شده است. گاهی وجود سلول التهابی ، باکتری ،گلبول قرمز و قارچ به میزان زیاد مانع تشخیص سلول غیر طبیعی میشوند. تاخیر در فیکس نمودن اسلاید و تماس آن با هوا نیز باعث تخریب سلولها میگردد. در نمونههایی که اسلاید ازلایه سلولی نازک تهیه شده است (Monolayer Cytology) مانند ThinPrep cytology در صد موارد منفی کاذب کمتر میگردد و چون سلول ها سریعا در محلول فیکساتیو قرار میگیرند ساختار سلولی بهتر حفظ میگردد. همچنین گلبولهای قرمز، سلولهای التهابی و موکوس از زمینه حذف میگردند.
سیتومورفولوژی: تشخیص مورفولوژیک تغییرات سلولی این ویروس یکی از بهترین روشهای تشخیصی در سیستم ژنیتال است. البته باید در نظر داشت که حدود یک سوم بیماران HPV DNA positive سیتولوژی غیر طبیعی دارند. در بیش از %80 موارد squamous intraepithelial lesions با استفاده از تکنیک های مولکولار ارتباط با این ویروس مشخص میگردد.
تظاهر بالینی معمولا به صورت ضایعات اپیتلیالی وروکوز یا flat بوده و خصوصیات سیتوپاتیک در تمامی این ها یکسان است.
ویروس پاپیلوما یک نوع ویروس Double stranded DNAمیباشد که هم هسته و هم سیتوپلاسم سلول را درگیر میسازد ودر سلولهای سنگفرشی سطحی تکامل یافته و باعث ایجاد سلول koilocyte میگردد. تغییرات سیتوپلاسمیک آن شاملDyskeratosis است که خصوصیت مهم عفونت این ویروس میباشد. خصوصیت کلاسیک ویروس وجود Koilocyte بوده که در سلولهای سنگفرشی مشاهده میگردد. در نمونههای سیتولوژی سرویکس مشاهده سلولهای Koilocytic تیپیک به نفع این عفونت ویروسی است که در اسمیر قادر بهSubtype نیستیم.
باید در نظر داشت که گاهی علیرغم وجود عفونت با این ویروس، تغییرات مورفولوژیک در اسمیر و بافت با میکروسکوپ نوری دیده نمیشود.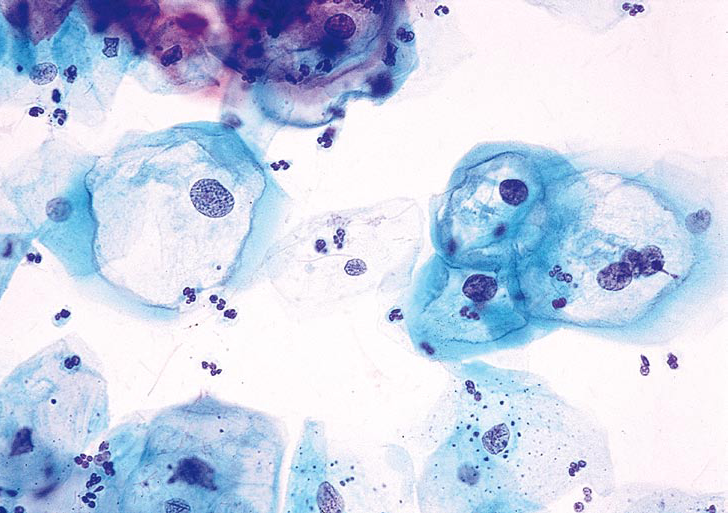
Grading Squamous Intraepithelial Lesions
بر طبق سیستم بتسدا از دو گروه low grade و high grade استفاده میشود. اکثریت موارد LSIL گذرا بوده و ریسک سرطانزایی آنها کم است. در حالیکه پتانسیل پیشرفت به کانسر در HSIL بالا میباشد.Koilocytosis و دیسپلازی خفیف ((CIN1 در گروه LSIL قرار دارند. دیسپلازی متوسط و شدید (CIN2,3) و کارسینوم IN situ در گروهHSIL قرار دارند. استاندارد طلایی تعیین HSIL و LSIL بررسی مورفولوژیک با میکروسکوپ است.
Low-Grade Squamous Intraepithelial Lesion
:
در 2 درصد کل نمونههای سیتولوژی دیده میشود. در %18 مواردی که در سیتولوژی LSIL گزارش میشوند در بیوپسی امکان دارد که CIN2,3 تشخیص داده شود.

High-Grade Squamous Intraepithelial Lesion
:
در 5/0 درصد کل نمونههای سیتولوژی دیده میشود. تشخیص افتراقی آن متاپلازی سنگفرشی وآتروفی، هیستیوسیتها، سلولهای پولیپ آتیپیک، تغییرات سلولی ناشی از IUD و بخصوص همراهی ASC-US باآتروفی است.
Atypical squamous cell (ASC)
:
در مواردی که تغییرات سیتولوژیک غیر طبیعی بوده ولی برای تشخیص squamous intraepithelial lesion کافی نیست از واژه atypical squamous cell استفاده میکنیم. در سیستم جدید بتسدا با توجه به تغییرات مورفولوژیک به دو دستهASC-US و ASC-H تقسیم میشوند. باید در زمان وجود التهاب شدید در سیتولوژی از تشخیص ASC اجتناب کرد. میزان در صد گزارش ASC-US حدود 7/4 وASC-H حدود 4/0 است. در نهایت باید در نظر داشت که تشخیص نهایی بر اساس کولپوسکوپی و بیوپسی ومشاهده تغییرات ناشی از ویروس است.
اپیدمیولوژی
بررسیهای اپیدمیولوژیک توزیع HPV در جوامع مختلف بسیار مهم است. %50 افرادی که رابطه جنسی دارند مستعد ابتلا به HPV میباشند و همچنین %16 زنان آلوده به ژنوتایپهای High risk در معرض ابتلا به سرطان دهانه رحم میباشند، به همین دلیل تحققات بسیار گستردهای در سراسر جهان انجام شده است. یکی از این تحقیقات که بین سالهای 1995 تا 2009 انجام شد و خود شامل 194 مطالعه گوناگون بود، یک میلیون خانم بدون هیچ مشکل سیتولوژیکی، در نقاط مختلف دنیا مورد بررسی قرار گرفتند، نشان داد که به طور میانگین میزان آلودگی به HPV، %7/11 میباشد که میزان شیوع آن در نقاط مختلف دنیا متفاوت است. بیشترین شیوع در کشورهای جنوب صحرای آفریقا 24، اروپای شرقی 4/21 و آمریکای لاتین 1/16 درصد دیده شد. میزان شیوع در مناطق مختلف به شرح زیر میباشد:
کشورهای توسعه یافته: 3/11%
کشورهای کمتر توسعه یافته: 8/11%
آفریقا: 21%
آمریکا: 11%
آسیا: 9%
اروپا: 14%
میانگین کلی: 7/11%
افرادی که مثبت بودند وقتی از نظر ژنوتایپ بررسی شدند، 5 ژنوتایپ که فراوانی بیشتری داشتند به شرح زیر بودند:
|
نوع ژنوتایپ |
درصد فراوانی |
|
16 |
3/2 |
|
18 |
1/4 |
|
52 |
9/0 |
|
31 |
8/0 |
|
58 |
7/0 |
شیوع کلی ژنوتایپها در مناطق مختلف به شرح زیر میباشد:
قاره اروپا: 16>31>18
قاره آفریقا: 16>52>18
آمریکای شمالی: 16>18>52
آمریکای لاتین و کارائیب: 16>18>31
آسیا: 16>18>52
شیوع درمجموع: 16>18>52>31
تا به امروز آماری در ایران به صورت رسمی گزارش نشده که بتوان به صورت قطعی به آن استناد کرد و از طرفی نتیجه برخی مطالعات تفاوت بسیار زیادی با یکدیگر داشتهاند. در بررسیهایی که در سال 93-94 در آزمایشگاه دنا (نیلوفر سابق) انجام شد 2903 نمونه که مورد بررسی قرار گرفتند و تعیین ژنوتایپ شدند، 45 درصد موارد مثبت بودند البته علت بالا بودن این آمار نسبت به آمارهای جهانی این است که افراد مراجعه کننده همگی مشکوک به ابتلا بودند در صورتی که در کشورهای دیگر بررسیهای انجام شده به صورت غربالگری است.
در بررسی انجام شده شیوع ژنوتایپها 16>31>18 در موارد High risk و در کل به ترتیب 6>16>11>42>43 بود.
Multiple infection
: یکی از مواردی که در جوامع مختلف مورد بررسی قرار گرفته ابتلا به ژنوتایپهای مختلف HPV به طور همزمان در یک فرد (Multiple infection) میباشد. در بررسیهایی که در آزمایشگاه نیلوفر انجام شده موارد متعددی از عفونتهای هم زمان مشاهده شد که از نظر تعداد به صورت زیر میباشد:
|
عفونت با بیشتر از 3 ژنوتایپ |
عفونت با 3 ژنوتایپ |
عفونت با 2 ژنوتایپ |
عفونت با 1 ژنوتایپ |
تعداد موارد مثبت |
|
(6%)86 |
(14%)188 |
(29%)382 |
(51%)665 |
1311 |
تشخیص آزمایشگاهی
از آنجا كه كشت سلولي و روشهاي سرولوژيك در شناسايي اين ويروس و انواع آن فاقد ارزش هستند، اهميت روشهاي ملكولي از جمله واكنش زنجيرهاي پليمراز (PCR) در تشخيص قطعي و زودرس اين ويروس آشكار ميگردد.
آزمايشات مولكولي در حال حاضر پيشرفتهترين و دقيقترين راه تشخيص ابتلا به HPV است كه با استفاده از پرايمرهاي اختصاصي برای تشخيص انواع ژنوم HPV به کار میرود.نتيجه كلي استفاده از روش هاي حساس مولكولي در تشخيص ابتلا به پاپيلوماي انساني بسیار مفيد بوده و بعلاوه با اين روش ميتوان انواع گونه هاي مختلف HPV در افراد بيمار و حتي در افراد به ظاهر سالم نيز شناسايي نمود.
تا به امروز روش های مختلفی از PCR مانند Nested-PCR و یا RFLP-PCR به صورت کیتهای تجاری برای شناسایی انواع تایپهای ویروس به بازار آمدهاند که دچار کاستیهایی مانند حساسیت پایین و نتایج مثبت و منفی کاذب میباشند. با ظهور Real-Time PCR و روشهای هیبریداسیون می توان با حساسیت و دقت بسیار بالاتر به شناسایی انواع پرخطر و کم خطر ویروس در انواع نمونههای بیماران پرداخت. یکی از بهترین روشها برای تشخیص و ژنوتایپینگ HPV استفاده ازDirect Flow Chip است که بر اساس تکنولوژی DNA-Flow است. در این روش که دارای حساسیت و ویژگی بالایی است نیازی به استخراج DNA نبوده و هردو مرحله غربالگری و ژنوتایپینگ همزمان انجام میگیرد. از مزایای دیگر آن میتوان به توانایی آن در بررسی نمونههای تازه و پارافینه اشاره کرد. علاوه بر این از آنجا که یک روش تمام اتوماتیک است، در کمتر از 2 ساعت میتوان جواب آزمایش را به دست آورد.
این تکنیک توانایی آن را دارد که 18 ژنوتایپ High risk و 18 ژنوتایپ Low risk را تشخیص دهد.
واکسیناسیون
در سرطان سرویکس بيش از هر نوع بدخيمي ديگري، اثرات پيشگيري ، تشخيص زودرس و درمان به موقع بر كاهش ميزان مرگ و مير مشهود است. آخرین آمار CDC محل کنترل بیماریهای عفونی در آمریکا نشان میدهد که مقایسه ی 3 سال قبل از واکسینه شدن با 3سال بعد از واکسینه شدن نتایجی معادل 50% کاهش در ابتلا داشته است. این آمار در دختران سنین 13-17 سال میباشد و تنها از هر 3 دختر آمریکایی در این سنین فقط 1 نفر واکسینه شده است. حالا تصور کنید اگر همه دختران این سنین و پسران هم واکسینه شوند چقدر خوشحال کننده است.
استرالیا اولین کشوری در دنیا است که از سال 2007 به طور روتین همه دختران و از سال 2013 همه پسران سنین 11_12 را واکسینه نموده است و نتایجی معادل 59% کاهش به دست آورده است. این آمار در آقایان معادل 28% بوده است.
علت اصلی عدم پذیرش واکیسیناسیون در آمریکا عدم آشنایی و توجیه پدران و مادران بوده است.
به هر حال هر واکسیناسیونی همراه با اختلالاتی نیز هست. باید همیشه در نظر داشته باشند که اول باید والدین جوانان توجیه شوند تا برنامهی واکسیناسیون به خوبی اجرا گردد.
چند نوع واکسن موجود است؟
الف- گارداسیل
ب- سرواریکس
هر دو واکسن بر روی HPV نوع 18 و 16 موثر هستند.
ولی گارداسیل در جلوگیری از ابتلا به ژنوتایپهای 11 و 6 یعنی عامل زگیل دستگاه تناسلی نیز موثر است. واکسن گارداسیل دارای سه مرحله تزریق میباشد به این صورت که دومین تزریق دو ماه بعد از اولین تزریق و سومین تزریق چهار ماه بعد از دومین تزریق صورت میگیرد.



